Maladies tropicales négligées

Les maladies tropicales négligées (souvent désignées sous l'acronyme anglo-saxon NTDs) sont un groupe de diverses maladies tropicales fréquentes au sein des populations à faible revenu dans les régions en développement d'Afrique, d'Asie et d'Amérique. Elles sont causées par divers pathogènes au premier rang desquels les parasites helminthes ou protozoaires, mais également les virus et les bactéries. En Afrique subsaharienne, l'impact de l'ensemble de ces pathologies est comparable au paludisme et à la tuberculose[1]. Certaines de ces pathologies peuvent être prévenues ou traitées par des moyens accessibles aux pays les plus développés, mais non dans les régions les plus pauvres du globe. Dans certains cas pourtant, les traitements sont relativement peu onéreux. Par exemple, le traitement de la bilharziose coûte 0,20 USD par enfant et par an en 2007[2]. Cependant, pour la période 2010-2017, le coût du contrôle de ces pathologies à l'échelle mondiale est estimé entre 2 et 3 milliards USD[3].
Ces maladies sont souvent mises en contraste avec les trois grands fléaux mondiaux que sont l'infection par le VIH, la tuberculose et le paludisme, lesquels bénéficient de nombreux fonds de recherche et de traitement. Les maladies tropicales négligées constituent pourtant des comorbidités fréquentes de ces infections[4]. Cependant, on observe de manière sporadique des dons de médicaments nécessaires par certaines compagnies pharmaceutiques et des politiques d'administration de masse ont été efficaces dans plusieurs pays[5].
Vingt maladies tropicales négligées ont été priorisées par l'Organisation mondiale de la santé. Ces maladies sont considérées comme endémiques dans 149 pays, affectant plus de 1 milliard de personnes dont plus de 500 millions d'enfants[6]. Bien que le poids économique de ces pathologies sur les économies en développement soit difficile à chiffrer, il est estimé à plusieurs milliards de dollars américain chaque année[7]. Elles ont provoqué 142 000 décès en 2013, chiffre en baisse par rapport aux 204 000 décès en 1990[8]. De ces vingt pathologies, l'OMS prévoit d'en éradiquer deux d'ici à 2030 : la dracunculose et le pian[7]. Par ailleurs, quatre sont ciblées pour élimination : le trachome, la maladie du sommeil, la lèpre et la filariose lymphatique d'ici à 2020[9].
Liste des maladies[modifier | modifier le code]
Il existe un débat au sein de l'Organisation mondiale de la santé (OMS), du CDC, et des experts en maladies infectieuses concernant les pathologies à classer comme maladies tropicales négligées. L'OMS reconnait vingt pathologies comme maladies tropicales négligées : l'ulcère de Buruli, la dengue et le chikungunya, la dracunculose, l'échinococcose, les trématodoses d'origine alimentaire, la trypanosomiase humaine africaine, la leishmaniose, la lèpre, la filariose lymphatique, le mycétome, la chromoblastomycose et les autres mycoses profondes, l'onchocercose, la rage, la gale et autres ectoparasitoses, la bilharziose, les géohelminthiases, les envenimations par serpent, le cysticercose, le trachome et le pian[7], auxquelles s'ajoute le noma à la suite d'une campagne menée par des médecins et des acteurs humanitaires[10].
Ces pathologies résultent de cinq types de pathogènes :
- les parasites protozoaires (maladie de Chagas, maladie du sommeil, leishmaniose) ;
- les bactéries (ulcère de Buruli, lèpre, trachome, pian) ;
- les vers parasites (cysticercose, dracunulose, échinococcose, distomatoses, filariose lymphatique, onchocercose, bilharziose, nématodoses instestinales) ;
- les virus (dengue et chikungunya, rage).
- les acariens (gale)
- les champignons (le mycétome, la chromoblastomycose et les autres mycoses profondes)
Ainsi que du venin de serpents.
Protozooses[modifier | modifier le code]
Trypanosomiase humaine africaine[modifier | modifier le code]

La trypanosomiase humaine africaine, ou maladie du sommeil, est une maladie vectorielle provoquée par des Trypanosoma brucei et transmise par la piqûre de glossine, également appelée mouche tsé-tsé[11]. Les deux sous-espèces de Trypanosoma brucei responsables de la trypanosomiase humaine africaine sont Trypanosoma brucei gambiense et Trypanosoma brucei rhodesiense[7].
On compte moins de 1 000 cas depuis 2017, tous en Afrique subsaharienne. Entre les années 2000 et 2023, le nombre de nouveaux cas par ans à diminué de 97 %. La pathologie est constamment fatale en l'absence de traitement.
Cette maladie peut prendre deux formes en fonction de la sous-espèce du trypanosome concerné : Trypanosoma brucei gambiense est, en 2023, responsable de 92 % des cas de maladie du sommeil. Il provoque une forme chronique de la maladie. Trypanosoma brucei rhodesiense provoque une forme aigüe de la maladie, et est responsable des 8 % des cas restants.
Dans un premier temps, les symptômes de la maladie sont vagues, incluant la fièvre, les céphalées, des adénopathies, la fatigue, l'arthralgie, et des démangeaisons. Dans sa deuxième phase, la maladie atteint le système nerveux central et provoque des symptômes plus reconnaissables, dont des troubles de la vision, des mouvements involontaires, des tremblements, une difficulté à s'exprimer, une perturbation du rythme circadien, l'incontinence urinaire, des convulsions, un déclin cognitif et en fin d'évolution le coma puis la mort[12].
La pentamidine, l'éflornithine, le nifurtimox et le fexinidazole sont des traitements efficaces contre la trypanosomiase humaine africaine[7], malgré le développement de résistances par le parasite. La maladie peut être diagnostiquée à travers un test sérologique simple.
Les mesures de prévention utilisées par l'OMS pour combattre cette maladie sont l'amélioration de l'accès à l'eau potable, le contrôle des populations de mouches tsé-tsé grâce à des pièges, le traitement des animaux domestiques infectés et l'utilisation d'insecticides[7].
Trypanosomiase américaine[modifier | modifier le code]
La trypanosomiase américaine, ou maladie de Chagas, est une maladie vectorielle transmise par les fèces d'un triatome infecté[13],[14]. Le protozoaire parasite peut pénétrer dans l'organisme par une brèche cutanée, liée ou non à la piqûre d'un triatome hématophage infecté. Il peut aussi pénétrer l'organisme par les muqueuses, par l'ingestion de liquide ou de nourriture infectés ou par l'inhalation de poussières contenant des fèces de triatome[14]. Il existe des transmissions verticales au cours de la grossesse, ou encore lors de la transfusion de poches de sang infecté.
En 2024, l'OMS estime entre 6 et 7 millions le nombre d'individus infectés par Trypanosoma cruzi, l'agent de la maladie, surtout en Amérique[15]. La morbidité est supérieure chez les patients immunodéprimés, les enfants et les personnes âgées, mais très faible en cas de prise en charge précoce car il existe des traitements efficaces[14]. En 2017, 10 000 personnes sont mortes de la maladie de Chagas[7].
La maladie de Chagas évolue en deux phases : une phase aigue et une phase chronique. La phase aiguë est habituellement asymptomatique. Dans la majorité des cas, les symptômes sont faibles et non spécifiques, comme la fièvre et des douleurs musculaires. Dans certains cas, le patient présente des lésions cutanées, un œdème d'une paupière, des adénopathies accompagnés de différents autres symptômes variés et dépendant du site d'inoculation[14]. Après la phase aigue, une phase chronique se développe parfois. Un tiers des patients atteints présentera par la suite des maladies cardiaques, et un dixième présentera des séquelles au système digestif.
La maladie de Chagas peut être prévenue d'abord par l'élimination des foyers domestiques de triatome, l'amélioration des habitats, l'installation de moustiquaires, l'amélioration de l'hygiène alimentaire, et le dépistage, notamment des femmes en âge de procréer et des donneurs de sang[14]. Le benznidazole et le nifurtimox sont des traitements très efficaces qui permettent de tuer le parasite[15].
Leishmaniose[modifier | modifier le code]

- 0
- 1-2
- 3
- 4-7
- 8-12
- 13-15
- 16-29
- 30-95
La leishmaniose est une maladie vectorielle transmise lors de la piqûre du phlébotome. Elle peut prendre trois formes : viscérale (kala-azar), cutanée, et muco-cutanée[16]. En 2023, l'OMS estime que le nombre de nouveaux cas annuels est entre 700 000 et 1 millions[17].
La forme viscérale est la plus grave : en l'absence de traitement, elle est fatale dans 95 % des cas. L'OMS estime entre 50 000 et 90 000 nouveaux cas par an. La forme cutanée est la plus courante, avec entre 600 000 et 1 million de nouveaux cas par ans. Elle provoque l'apparition d'ulcères et laisse des cicatrices à vie[17].
La prévention repose sur la protection contre les piqûres et le contrôle des populations de phlébotomes. Un vaccin est en cours de développement[réf. nécessaire].
Infections bactériennes[modifier | modifier le code]
Lèpre[modifier | modifier le code]

La lèpre, ou maladie de Hansen est une maladie chronique provoquée par Mycobacterium leprae.
L'OMS estime 200 000 nouveaux cas chaque année[18]. Un à deux millions d'individus sont handicapés ou défigurés en raison d'une lèpre active ou passée[réf. souhaitée]. En effet, en l'absence de traitement, la lèpre est une maladie incapacitante. La transmission se fait entre individus par l'intermédiaire de gouttelettes issues de sécrétions nasales et buccales (gouttelettes de Flügge), l'incubation pouvant alors durer de 5 à 20 ans.
Les symptômes les plus courants sont l'apparition de lésions cutanées, une perte de sensation au niveau de la peau, l'apparition de plaques hypopigmentées, le gonflement des nerfs périphériques, avec une perte de sensation et/ou des faiblesses musculaires[18].
Des traitements efficaces existent pour guérir de la lèpre. En général, une pluri-antibiothérapie permet de tuer le pathogène. Une prise en charge précoce de la maladie permet d'éviter le handicap[18]. Le vaccin BCG possède un certain effet préventif contre la lèpre[19]. La chimiothérapie préventive permet de prendre en charge la lèpre avant même l'apparition de symptômes.
Ulcère de Buruli[modifier | modifier le code]
L'ulcère de Buruli est une maladie chronique provoquée par Mycobacterium ulcerans.
En 2019, 2 260 nouveaux cas ont été répertoriés, surtout en Afrique subsaharienne, au Pacifique ouest et en Amérique du Sud[7].
La maladie commence par former un nodule, une petite boule palpable sous la peau, une plaque, ou un œdème. Le nodule, la plaque ou l'œdème évolue en quatre semaines pour devenir un ulcère. Les ulcères peuvent se surinfecter, et atteindre l'os, handicapant et défigurant les patients. Le taux de mortalité est bas, bien que des surinfections de lésions initiales puissent être létales[20]. Le traitement repose sur la chirurgie et les antibiotiques[20] et lorsqu'il est précoce, il permet d'éviter le développement de la majorité des symptômes[20].
Trachome[modifier | modifier le code]
Le trachome est une infection de l'œil par le Chlamydia trachomatis. Malgré un pronostic fonctionnel péjoratif, le risque de mortalité est très bas[21]. Chlamydia trachomatis se dissémine à partir de sécrétions oculaires et nasales sur les mains, les vêtements ou encore les mouches s'abreuvant de ces sécrétions[22].
C'est la première cause de cécité dans le monde. En 2022, l'OMS estime que 1,9 million de personnes sont malvoyantes à cause du trachome dans le monde[22], et que en 2019, 2,5 millions de personnes avaient besoin de chirurgie à cause d'un trachome.
La symptomatologie consiste en une inflammation de la face interne des paupières provoquant une déformation de la structure de la paupière et une mise en contact des cils avec la cornée qui s’opacifie à force de frottements[22].
Le traitement repose sur l'utilisation d'antibiotiques, au premier rang desquels l'azithromycine en collyre, ainsi que sur la chirurgie. La prévention repose sur la chimiothérapie de masse préventive, l'hygiène personnelle, l'amélioration de l'accès à l'eau propre, l'évacuation des eaux usées et le contrôle des populations de Muscidae[7]. En 2014, les campagnes répétées de traitement et d'éducation des populations concernées semblent n'avoir eu que très peu d'effet tandis que la seule mesure de prévention efficace reste l'accès à une éducation de base des populations atteintes[23].
Pian[modifier | modifier le code]

Le pian est une maladie chronique provoquée par un tréponème, Treponema pallidum pertenue. Elle se transmet par le contact. Plusieurs projets d'éradication du pian ont eu lieu : en 1950 puis en 2012 prolongée en 2020.
En 2020, 87 877 cas de pian suspectés sont répertoriés par l'OMS, parmi lesquels seuls 346 sont confirmés, la majorité au Pacifique ouest. Entre 75 % et 80 % des personnes affectées par le pian ont moins de 15 ans. Les populations les plus touchées sont les communautés pauvres dans les régions chaudes et humides d'Afrique, d'Asie, d'Amérique latine et du Pacifique, dans les zones rurales et éloignées des services de santé[24].
Le pian commence par l'apparition d'un papillome sous la peau remplis de Treponema pallidum pertenue. En absence de traitement, le papillome commence ensuite à s'ulcérer. Les infections secondaires provoquent des lésions cutanées jaunes, et la dactylite. Le traitement repose sur les antibiotiques, surtout l'azithromycine, mais aussi la pénicilline. Les efforts d'éradication passent par l'utilisation préventive d'azithromycine de masse chez les populations à risque, et par l'éducation à l'hygiène personnelle. L'éradication du pian devrait avoir lieu avant 2030[7].
Verminoses[modifier | modifier le code]
Cysticercose et téniases[modifier | modifier le code]
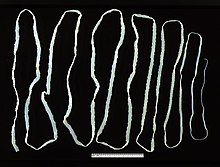
La cysticercose et les téniases sont des maladies parasitaires causées par des Cestoda. La cysticercose est provoquée par la présence de larves de Taenia solium dans les tissus, tandis que les téniases sont provoqués par la présence dans les intestins de vers adultes de nombreuses espèces telles que Taenia solium, Taenia saginata, Hymenolepis nana, Dipylidium caninum ou Diphyllobothrium latum[25]. Ces maladies sont des helminthiases. Les cestodes pénètrent l'organisme via l'ingestion de nourriture ou de boisson contaminées par des œufs de Taenia solium présents dans des selles humaines, tandis que les téniases se transmettent par l'ingestion de viande infectée et insuffisamment cuite, généralement du porc[26].
En 2019, l'Institute for Health Metrics and Evaluation estimait 4,83 millions de cas de cysticercose, ayant provoqué 1 050 morts[27]. L'OMS estime que 5,5 millions de personnes sont infectées par la cysticercose et les téniases dans le monde, et qu'elles ont provoqué 28 000 morts en 2015[7]. On les retrouve surtout en Afrique, en Asie du sud-est et au Pacifique ouest.
La cysticercose peut atteindre différents tissus et organes. Les larves préfèrent infecter les muscles, mais dans les cas les plus graves, elles sont présentes dans le système nerveux central, où elles peuvent provoquer des symptômes neurologiques. On parle alors de neurocysticercose. Les symptômes de la neurocysticercose incluent des maux de tête chroniques, cécité, épilepsie, hydrocéphalie et méningite. Les téniases provoquent des douleurs abdominales, la nausée, des diarrhées et des constipations[26].
Les médicaments anthelminthiques tels que le niclosamide, le praziquantel ou l'albendazole sont des traitements efficaces contre les téniases, autant pour guérir les patients que de façon préventive. Pour les cysticercoses, le traitement est plus difficile, des doses élevées et répétées de praziquantel et d'albendazole sont nécessaires, ainsi que des corticostéroïdes et des antiépileptiques pour en traiter les symptômes. La chirurgie peut être efficace pour retirer les kystes[26].
La prévention passe par l'utilisation de chimiothérapies anthelminthiques préventives, l'évacuation des eaux usées et des fèces humaines, le lavage des mains avant la manipulation de nourriture, la cuisson suffisante de la viande, la vaccination des porcs, la vermifugation des porcs et l'amélioration de l'hygiène des condition d'élevage des porcs[7].
Échinococcose[modifier | modifier le code]

Les échinococcoses sont des maladies provoquées par l'infection par un Echinoccocus. Il existe deux types d'échinococcoses : l'échinococcose kystique (ou hydatidose) provoquée par Echinococcus granulosus, et l'échinococcose alvéolaire provoquée par Echinococcus multilocularis. Elle se transmet par l'ingestion d'eau ou de nourriture contaminées par des fèces de chiens, de renards ou de moutons[7].
L'échinococcose cystique provoque des cystes douloureux au foie et aux poumons, provoquant des vomissements, de la toux et une dyspnée. L'échinococcose alvéolaire provoque des lésions commençant au niveau du foie et entrainant une perte de poids rapide et des douleurs abdominales. En l'absence de traitement, l'échinococcose alvéolaire peut provoquer une insuffisance hépatique, une cirrose du foie ou des cancers du foie et être létale[7].
En 2011, au moins un million de personnes étaient infectées par un Echinococcus. En 2016, 19 000 personnes en sont mortes. On la retrouve sur tout les continents, avec des concentrations plus importantes autour du bassin méditerranéen, en Amérique du Sud, en Afrique subsaharienne et en Asie centrale[7].
Son traitement passe par l'utilisation d'anthelminthiques comme l'albendazole et par la chirurgie pour retirer le kyste. La prévention se base sur la vermifugation des animaux de compagnie, l'amélioration des conditions d'élimination de leurs selles, l'amélioration des conditions d'hygiène globale concernant notamment l'alimentation et la boisson[28].
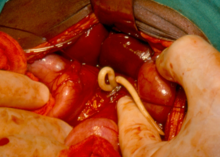
Dracunculose[modifier | modifier le code]

La dracunculose, également connue sous le nom de filariose de Médine, est une maladie provoquée par le ver de guinée. Cette maladie est handicapante pendant plusieurs semaines.
Un programme d'éradication de l'OMS, soutenu par la Fondation Carter a permis de réduire la prévalence et l'incidence de la maladie de façon drastique[29]. Ainsi, seuls 14 cas de dracunculose étaient recensés en 2023[30], contre 113 en 2013, et 3 500 000 cas estimés en 1986[31]. L'OMS prévoit ainsi d'éradiquer la dracunculose d'ici 2030.
La transmission a lieu lors de l'ingestion d'eau infestée par des crustacés aquatiques, les cladocères, eux-mêmes infectés par la larve de Dracunculus medinensis[29]. La pathologie n'est pas létale en elle-même, mais peut être la cause d'une inactivité prolongée en raison des plaies durables et handicapantes qu'elle induit.
Le traitement consiste en le nettoyage et le bandage des plaies provoquées par l'issue du parasite environ un an après l'infection, en général en zone distale du membre inférieur (classiquement, la zone péri-malléolaire). Ceci est associé à l'extraction très lente du parasite en l'entourant autour d'une petite pièce de bois. L'extraction est de l'ordre du centimètre par jour, le traitement étant ainsi très long, le parasite pouvant mesurer plus d'un mètre de long[29]. Une extraction plus rapide est dangereuse en raison du risque de rupture du parasite qui entraînerait d'importants troubles allergiques chez le patient pouvant conduire au choc anaphylactique puis au décès.
La dracunculose peut être prévenue par la filtration de l'eau, l'identification rapide des cas afin de prévenir le risque de dissémination et le traitement des eaux de boisson avec des larvicides. Le cycle du parasite étant long, de l'ordre d'un an, ces méthodes sont rapidement efficaces lorsqu'elles sont suivies à l'échelle d'une population.
Filariose lymphatique[modifier | modifier le code]
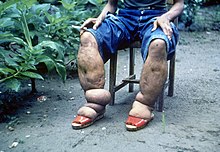
La filariose lymphatique est une maladie provoquée par l'infection de filaires, en particulier de Wuchereria bancrofti, Brugia malayi et Brugia timori. C'est une maladie vectorielle provoquée par la piqûre de moustiques infectés des genres Culex, Anopheles, Mansonia et Aedes.
En 2018, 51,4 millions de personnes sont infectées, surtout en Asie du sud, en Asie du sud-est et en Afrique subsaharienne. En 2012, 40 millions de personnes sont atteintes de difformités à cause de cette maladie[32].
Cette maladie est rarement fatale[33], mais les dommages liés au parasite perdurent pour le reste de la vie des patients. Ils consistent en des lymphœdèmes des membres, allant jusqu'à l'éléphantiasis, des pathologies génitales et des crises douloureuses. La plupart des patients infectés sont asymptomatiques mais présentent des dommages du système lymphatique et plus de 40 % des patients infectés présentent des dommages rénaux pouvant entraîner une insuffisance rénale[34].
Le diagnostic se fait par l'examen parasitologique du sang de patient, prélevé en milieu de journée ou en milieu de nuit (en général les deux) en fonction de l'espèce infectante considérée[33]. Le traitement historique des filarioses est la diéthylcarbamazine. Toutefois, un traitement antihelmintique à base d'ivermectine ou d'albendazole voire de praziquantel est efficace[35]. Une autre stratégie consiste en l'administration de doxycycline, antibiotique ciblant la Wolbachia, bactérie symbiotique du parasite.
La prévention passe par la lutte contre les vecteurs et leurs piqûres et l'administration préventive de filaricides et de microfilaricides.
Onchocercose[modifier | modifier le code]

L'onchocercose, également connue comme « cécité des rivières », est une maladie provoquée par l'infection par le nématode Onchocerca volvulus, transmis par une mouche hématophage du genre Simulium. Cette mouche se trouve principalement le long de cours d'eau rapides[36].
En 2017, l'OMS estime 21 millions de cas d'onchocercose, principalement en Afrique subsaharienne, avec des cas au Yémen, au Brésil et au Venezuela[7].
Le nématode infecte la peau et les yeux, et provoque des démangeaisons sévères, une dépigmentation de la peau et une perte de vision, pouvant aller jusqu'à provoquer une cécité totale[36].
L'ivermectine est un traitement efficace contre l'onchocercose, autant pour en traiter les symptômes que de façon préventive. L'utilisation d'insecticides permet de contrôler les populations de Simulium[7].
Bilharziose[modifier | modifier le code]
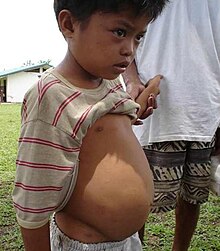
La bilharziose ou schistosomiase est une maladie provoquée par l'infection par des trématodes du genre Schistosoma. Elle est provoquée par le contact avec de l'eau contenant des larves de Schistosoma, lors de baignade, ou en nettoyant des vêtements. Ces larves se développent dans des escargots d'eau douce, qui en sont l'hôte intermédiaire[7].
On décompte plus de 200 millions de cas de bilharziose dans le monde[7],[32]. On estime que 85 % de ces cas sont situés en Afrique subsaharienne[32]. En 2023, l'OMS estime à 11 792 le nombre de morts annuels provoqués par cette maladie[37].
La bilharziose peut prendre deux formes : intestinale et urogénitale. Dans la forme intestinale, la maladie provoque des douleurs abdominales, diarrhée, saignements intestinaux, varices œsophagiennes[21], fièvre, une hypertension portale et l'ascite. La forme urogénitale provoque l'hématurie, une fibrose de la vessie, des dégâts aux uretères et aux reins, des douleurs aux testicules, l'apparition de sang dans le sperme, des douleur pelviennes, des douleurs pendant les rapports sexuels. Elle peut être cause de grossesse extra-utérine, d'infertilité, de cancer de la vessie[37],[7]. L'infection par le parasite est également la cause de lésions du col utérin chez la femme et la petite fille, augmentant le risque de transmission du VIH[32].
La maladie peut être diagnostiquée par test sérologique, produisant de nombreux faux positifs, mais également par l'examen direct des selles et des urines (éventuellement des crachats) à la recherche d’œufs[32]. Le praziquantel est utilisé pour traiter les patients atteints de schistosomiase mais ne prévient pas la réinfection. Le coût de prévention est estimé à 0,32 USD par enfant et par an[32] et consisterait en une administration de masse de praziquantel, un meilleur accès à de l'eau propre, une amélioration des conditions d'hygiène et une éducation à la santé des populations concernées[21]. Des vaccins sont également en cours de développement, notamment le Bilhvax.
Géohelminthiases[modifier | modifier le code]
Les géohelminthiases sont des helminthiases provoquées par le contact avec des œufs et des larves d'helminthes dans les sols contaminés par des fèces humaines. Les principaux helminthes responsables de géohelminthiases sont Ascaris lumbricoides, Trichuris trichiura, Necator americanus, Ancylostoma duodenale et Strongyloides stercoralis.
En 2016, 1,5 milliard de personnes sont infectées par une géohelminthiase, et 6 300 personnes en sont mortes.
L'albendazole et le mébendazole sont des traitements efficaces contre les infection par Ascaris lumbricoides, Trichuris trichiura, Necator americanus et Ancylostoma duodenale, et l'ivermectine est efficace contre les infections par Strongyloides stercoralis. L'OMS les distribue de façon préventive chez les enfants et les femmes en âge de procréer des populations à risques. La prévention passe surtout par la gestion des eaux usées et l'amélioration de l'accès à l'eau propre.
Trématodoses d'origine alimentaire[modifier | modifier le code]
Les trématodoses d'origine alimentaire sont des maladies provoquées par l'ingestion de nourriture infectée par les larves de trématodes, et insuffisamment cuites. Les trématodes en question sont Clonorchis sinensis, Opisthorchis viverrini, Opisthorchis felineus, Fasciola hepatica, Fasciola gigantica, ainsi que par les espèces du genre Paragonimus. On retrouve ces larves dans des poissons d'eau douce, des fruits de mer, des crabes et des écrevisses. Une cuisson suffisante permet de tuer les larves.
Les trématodoses d'origine alimentaire provoquent des douleurs abdominales, une inflammation et une fibrose hépatique. Elles peuvent provoquer un cholangiocarcinome, un blocage des voies biliaires et un ictère.
Ces maladies affectent 200 000 personnes chaque année, et en tuent 7 000. On les retrouve surtout dans le Pacifique ouest, et en Méditerranée de l'est.
Les chimiothérapies anthelmintiques sont efficaces contre les trématodoses d'origine alimentaire, l'OMS recommande l'utilisation préventive de praziquantel et de triclabendazole. La chirurgie comme l'hépatectomie partielle peut être pratiquée.
Les mesures préventives sont l'accès à de l'eau potable, le traitement des eaux usées , une conservation adéquate de la nourriture, la cuisson de la nourriture, le contrôle des poissons, fruits de mer, crabes et écrevisses pêchées, ainsi que la vermifugation des animaux de compagnie.
Viroses[modifier | modifier le code]
Dengue et chikungunya[modifier | modifier le code]
La dengue et le chikungunya sont des maladies infectieuses vectorielles provoquées par des virus : le virus du chikungunya et le virus de la dengue. Ces virus se transmettent par la piqûre de moustiques du genre Aedes (Aedes aegypti et Aedes albopictus).
En 2017, l'OMS estime à 104 millions le nombre d'infections par le virus de la dengue, surtout en Afrique subsaharienne, en Amérique du Sud et en Asie du sud-est. En 2016, 40 000 personnes sont mortes de la dengue[7]. Le nombre d'infection par le virus du chikungunya est difficile à estimer, probablement plus de 100 millions de cas entre 2004 et 2017.
Les symptômes de la dengue sont des douleurs musculaires et aux articulations, la fièvre, des maux de tête sévères, la nausée, des vomissements, la détresse respiratoire. Ceux du chikungunya sont similaires : fièvre, douleurs musculaires, maux de tête et douleur aux articulations pouvant durer plusieurs mois à plusieurs années.
La prévention de ces maladies passe par le contrôle des populations de vecteurs par l'utilisation de pesticides, la modification de l'environnement, la couverture des réservoirs d'eau, ainsi que par l'utilisation de moustiquaires.
Rage[modifier | modifier le code]

La rage est une maladie provoquée par l'infection par le virus de la rage et d'autres Lyssavirus. Elle se transmet surtout par la salive d'animaux infectés, en général des chiens domestiques. Elle peut se transmettre par morsure, mais aussi par contact entre de la salive infectée et des muqueuses ou des plaies ouvertes[38].
En 2023, la rage provoque des dizaines de milliers de morts chaque années. Par exemple, l'OMS estime que en 2015, 59 000 personnes sont mortes de la rage. On la retrouve surtout en Asie et en Afrique, ainsi qu'en Europe de l'Est, en Bolivie et aux Antilles. 40 % des personnes affectées par la rage sont des enfants de moins de 15 ans[38].
La rage provoque une inflammation du cerveau et de la moelle spinale. Les premiers symptômes sont la fière, la douleur et la sensation de brûlure au site d'infection. Elle peut ensuite prendre deux formes : la forme furieuse dans 80 % des cas, et la forme paralytique dans 20 % des cas. La forme furieuse provoque une hyperactivité, une excitabilité, des hallucinations, une hydrophobie et une aérophobie. La forme paralytique provoque la paralysie progressive des muscles à partir du site d'infection. Les deux formes sont toujours fatales après le développement des symptômes[38].
Il est impossible de diagnostiquer une rage avant le début des symptômes mais peut être détecter après le début des symptômes. Elle peut être prévenue par la vaccination des humains et d'animaux non humains tels le chien par le nettoyage et la désinfection des blessures (prophylaxie post-exposition), et par le contrôle des populations de chiens sauvages. Il n'existe pas de traitement curatif[38],[7].
Autres maladies tropicales négligées[modifier | modifier le code]
Mycétome, chromomycose et autres mycoses profondes[modifier | modifier le code]
Le mycétome, la chromomycose et les autres mycoses profondes sont des maladies provoquées par l'infection par des fonges. Elles sont catégorisées par l'OMS comme des maladies tropicales négligées seulement depuis 2017[7].
Le mycétome est provoqué par l'infection par une bactérie (actinomycétome) ou un fonge (eumycétome). La peau, les muscles, les tissus conjonctifs et les os sont infectés. Elle touche surtout les personnes qui travaillent dans l'agriculture et l'élevage[7].
La chromomycose et les autres mycoses profondes sont des infections cutanées et sous-cutanées provoquées par des fonges. La chromomycose provoque des déformations, des lésions cutanées verruqueuses, une invalidité et peut provoquer un cancer de la peau. Des antifongiques sont utilisés pour la traiter[39]. Au moins 10 000 cas ont été notifiés depuis les années 1940[7].
Gale et autre ectoparasitoses[modifier | modifier le code]
La gale et les autres ectoparasitoses sont des maladies provoquées par l'infection cutanée par un acarien microscopique, Sarcoptes scabiei var. hominis. L'acarien femelle s'enfonce sous la peau et y pond ses œufs, ce qui provoque une réponse immunitaire et la maladie. Elles sont considérées comme des maladies tropicales négligées par l'OMS seulement depuis 2017[7].
En 2019, 200 millions de personnes sont affectées par la gale[7].
L'ivermectine et l'application topique d'acaricide sont des traitements efficaces pouvant être utilisés pour guérir et prévenir de la gale et des autres ectoparasitoses[7].
Envenimation par serpent[modifier | modifier le code]
Les envenimations par serpent désignent les maladies provoquées par l'injection de diverses toxines lors d'une morsure de serpent, ou par le contact entre le jet de venin de certaines espèces de serpents et les yeux. Elles sont considérées comme une maladie tropicale négligée par l'OMS depuis 2017[7].
En 2016, 2,7 millions de personnes sont mordues par un serpent avec l'injection d'un venin, et entre 80 000 et 140 000 personnes en sont mortes. La plupart des cas sont concentrés en Amérique latine et aux Antilles, en Océanie, et en Asie[7].
Elles peuvent provoquer un état de choc circulatoire, une paralysie pouvant atteindre les muscles respiratoires, des problèmes de coagulation sanguine pouvant provoquer des hémorragies ou encore des blessures aigues aux reins. Elle peut avoir pour conséquence au long terme le handicap et l'amputation d'un membre[7].
Elle peut être traitée par l'utilisation d'un antivenin, et les symptômes peuvent être traités par le personnel médical. L'amélioration des habitations pour empêcher aux serpents d'entrer dans les maisons, l'utilisation de chaussures, et l'éclairage permettent de réduire les risques de morsures de serpents[7].
Conséquences économiques[modifier | modifier le code]
Les maladies tropicales négligées coûtent l'équivalent de plusieurs milliards de USD aux communautés touchées, en raison du coût des traitements, la baisse de productivité et de l'impact de ses maladies sur la situation socioéconomique et sur l'accès à l'éducation. De plus, les populations touchées sont, en général, des populations déjà appauvries[7].
En 2010, le l'impact économique des maladies tropicales négligées est encore sous-évalué, le rapport cout-efficacité des traitements est difficile à chiffrer[40]. En 2021 retour sur investissement des mesures de contrôle des maladies tropicales négligées est estimé entre 14 et 30 %, en fonction de la maladie et de la région du monde considérée[41]. De manière générale, l'OMS estime que pour chaque USD investi dans la lutte contre les maladies tropicales négligées, l'équivalent de 25 USD de bénéfice sont obtenus pour les patients traités. Une élimination des verminoses à long terme permettrait une diminution de 25 % de l'absentéisme scolaire et une augmentation du revenu des adultes de 20 %[42].
Cependant, le coût du traitement de certaines de ces maladies, comme l'ulcère de Buruli, peut revenir à plus de deux revenus annuels d'un foyer vivant dans le quartile aux plus faible revenus, alors que dans le quartile aux plus hauts revenus la charge représente un peu moins du revenus annuel moyen par foyer. Ces coûts élevés impactent la qualité du traitement et peuvent mener à une ruine financière. Ces maladies ont également un coût public en termes de développement de programme de santé publique et de perte de productivité de la main-d'œuvre en raison de la morbidité et d'une réduction de l'espérance de vie. Au Kenya, par exemple, on estime qu'une élimination des verminoses permettrait d’augmenter le revenu des adultes de 40 %, représentant un ratio bénéfices/coût de 100 %. On estime à 118 USD la perte de productivité engendrée par chaque cas de trachome. Chaque cas de bilharziose cause une perte de 45,4 jours de travail par an. La plupart des maladies considérées provoquent des pertes économiques des pays en voie de développement se chiffrant par millions de dollars[40].
Impact social[modifier | modifier le code]
De nombreuses maladies tropicales négligées telles que la lèpre peuvent causer des difformités sévères résultant en une stigmatisation et une mise à l'écart du reste de la société. Un autre exemple frappant est la filariose lymphatique dont les conséquences marginalisent les patients y compris en leur interdisant le travail[32]. Des études au Ghana et au Sri Lanka ont montré que des groupes de soutien aux personnes atteintes de filariose lymphatique peuvent améliorer l'estime de soi des patients, leur qualité de vie et leur relations sociales en leur apportant soutien social et conseils pratiques sur la façon de gérer leur maladie[43].
Les traitements vermifuges sont corrélés à une augmentation de la fréquentation scolaire[32]. De manière générale, les maladies tropicales négligées réduisent beaucoup la fréquentation et les résultats scolaires, ainsi que les capacités cognitives. En particulier, l'utilisation de traitements antihelminthique préventifs augmente la fréquentation scolaire des filles, ce qui est une façon efficace de réduire les inégalités de genre[44].
L'impact des maladies tropicales négligées est dans certaines situations lié au sexe. Les maladies tropicales négligées affectent particulièrement les femmes, notamment la bilharziose, la dengue ou les helminthiases. Elles sont par ailleurs sujettes aux infections durant la grossesse et il existe un risque de transmission de la mère à l'enfant, notamment dans le cas de la maladie de Chagas[45]. Une étude en Ouganda trouvait que les femmes accédaient plus facilement au traitement en raison d'un temps disponible plus important et d'une plus grande acceptation du traitement, mais l'ignorance d'éventuels effets adverses des médicaments sur les femmes enceintes limitait le recours à des soins adaptés. Ainsi, cet article concluait que le sexe devait entrer en compte dans l'élaboration des protocoles de traitement adapté[46].
Santé publique[modifier | modifier le code]
La lutte contre les maladies tropicales négligées fait partie d'une des cibles de l'objectif 3 de développement durable de l'Organisation des nations unies.
D'après Fenwick, il sera impossible d'atteindre les objectifs de développement pour le millénaire, tels que l'éducation, la mortalité infantile ou santé maternelle tant que la prévalence des maladies tropicales négligées se maintient au niveau actuel. Il affirme par ailleurs que de nombreux individus souffrent de plusieurs maladies tropicales négligées de façon concomitante[32].
Les traitements vermifuges sont corrélés à la reprise d'un poids physiologique, ce qui est logique considérant que les vers sont responsables en partie de la malnutrition de leur hôte. La distribution de traitement vermifuges semble être une méthode plus efficace pour lutter contre la malnutrition des enfants que le don de nourriture dans les écoles[44]. Les campagnes de distribution de médicaments antihelminthiques augmentent les capacités cognitives des patients, au court et au long terme.
Hotez milite pour l'inclusion des NTDs au sein des initiatives pour le paludisme, l'infection par le VIH et la tuberculose, tenant compte des nombreux liens existants entre les trois fléaux et les NTDs. Il note également la corrélation existant entre des taux élevés de NTDs et des taux élevés de maladies chroniques non transmissibles telles que des pathologies cardiaques dégénératives ou des cancers. Il attribue cette corrélation aux conséquences à long termes de pathologies inflammatoires telles que les NTDs développant un terrain favorable à des maladies chroniques non transmissibles[45].
Pourquoi ces maladies sont-elles négligées ?[modifier | modifier le code]
D'après Feasey, ce groupe de maladies est négligé en raison de la population qu'elles touchent, des patients pauvres dans les pays les plus pauvres, mais également en raison d'une attention portée particulièrement sur le contrôle de l'infection par le VIH, la tuberculose et le paludisme[21]. D'après Fenwick, il n'est pas illogique que la lutte contre ces trois grands fléaux ait été privilégiée financièrement eu égard au nombre important de personnes touchées et de la connaissance du public (notamment occidental) de ces trois maladies. Par ailleurs, il suppose que l'importance des maladies tropicales négligées a été sous-estimée puisqu'elles sont souvent asymptomatiques pendant de nombreuses années au cours d'une période d'incubation[32]. Le lien entre un décès et une maladie tropicale négligée d'évolution très lente voire latente, n'est pas souvent réalisé[32]. Dans un article du Financial Times on pouvait lire que le manque d'attrait commercial de ces pathologies et les patients qu'elles touchent limitaient le développement de la recherche et de l'innovation dans ce domaine. Ainsi, la responsabilité de la gestion de ces maladies incombe aux gouvernements ou à des organisations philanthropiques[47].
Prévention[modifier | modifier le code]
Tandis que Fenwick argue du fait que la prévention et l'éradication sont importantes en raison « de l'épouvantable stigmatisation, la défiguration, la cécité et les déficiences causées par les maladies tropicales négligées »[32], Hotez publie un article en 2013, dans lequel il évoque une potentielle élimination ou éradication de la dracunculose, la lèpre, la filariose lymphatique, l'onchocercose, le trachome, la maladie du sommeil, la leishmaniose viscérale, et la rage dans les dix ans à venir[45]. Un journal dédié maladies tropicales négligées, PLoS Neglected Tropical Diseases, a été lancé en 2007. Il existe également un groupement international dédié au contrôle des NTDs appelé Global Network for Neglected Tropical Diseases Control[21].
Marché et initiatives pharmaceutiques[modifier | modifier le code]
Les entreprises de biotechnologies ont fait des maladies tropicales négligées une cible en raison du besoin d'amélioration de l'état de santé global des populations issues du monde en développement[48]. L'administration massive de médicaments est considérée comme une méthode possible d'éradication, en particulier concernant la filariose lymphatique, l'onchocercose et le trachome, et ceci malgré le problème potentiel représenté par le développement de résistances aux médicaments[49]. D'après Fenwick, l'entreprise Pfizer aurait donné gracieusement 70 millions de doses de médicaments en 2011 afin d'éliminer le trachome, dans le cadre de l’International Trachoma Initiative[32]. L'entreprise Merck a aidé l’African Programme for the Control of Onchocerciasis (APOC) et Onchocerciasis Elimination Program for the Americas (OEPA) en faisant don d'ivermectine[32]. L'entreprise aurait également promis de mettre à disposition 200 millions de comprimés de praziquantel sur 10 ans[32]. Le groupe GlaxoSmithKline a fait don de deux milliards de comprimés pour le traitement de la filariose lymphatique et promis 400 millions de comprimés anthelminthiques pour la période 2010 - 2015. Le groupe Johnson & Johnson aurait promis 200 millions de comprimés anthelminthiques par an[32]. Novartis aurait promis la mise à disposition d'un traitement de la lèpre. L'entreprise EISAI s'engage à mettre à disposition deux milliards de comprimés de traitement contre la filariose lymphatique[32].
Actions politiques[modifier | modifier le code]
Il existe de nombreuses campagnes de prévention et d'éradication soutenues par l'Organisation Mondiale de la Santé×, l'Agence des États-Unis pour le développement international, la fondation Bill-et-Melinda-Gates ou encore le Département du Développement international britannique[32].
La Food and Drug Administration (FDA) américaine émet des « bons d'avis de priorité » visant à inciter les compagnies à investir dans la recherche de nouveaux médicaments et vaccins pour les maladies tropicales. Ainsi, la FDA a la possibilité de délivrer ces bons à n'importe quelle compagnie pharmaceutique obtenant une autorisation de mise sur le marché pour un traitement d'une des maladies listées. Ce bon peut être utilisé plus tard par la compagnie afin d'accélérer la procédure d'autorisation par la FDA de n'importe quelle molécule, même sans rapport avec les NTDs. Ce programme concerne toutes les maladies tropicales, y compris le paludisme et la tuberculose. Le premier bon ainsi délivré l'a été pour le Coartem, un traitement anti-paludique[50]. Le terme « négligé » n'est pas utilisé dans la définition du programme bien que la majorité des maladies listées font en fait partie du groupe des maladies tropicales négligées selon la définition de l'OMS.
Organisations non gouvernementales[modifier | modifier le code]
Il existe actuellement deux ONG se concentrant exclusivement sur les maladies tropicales négligées[51] : Schistosomiasis Control Initiative (SCI) et Deworm the World Initiative (DtWI), par Evidence action. Malgré un manque de fonds financiers patent, le traitement et la prévention des maladies tropicales négligées est « coût-efficace ». Le coût du traitement d'un enfant atteint d'une helminthiase ou d'une bilharziose est par exemple inférieur à 0,50 USD par année lorsqu'il est administré dans le cadre d'administration de masse au sein de la population scolaire par DtWI. Ce programme est recommandé par Giving What We Can et le Consensus de Copenhague comme une des solutions à la fois les plus efficaces et les plus « coût-efficaces ». Les efforts de SCI pour lutter contre les maladies tropicales négligées inclus l'usage de kit dits « d'impact rapide » contenant quatre ou cinq médicaments et une formation des enseignants sur la manière de les administrer.
Initiatives public-privé[modifier | modifier le code]
En 2013, le gouvernement japonais, cinq compagnies pharmaceutiques japonaises, la Bill & Melinda Gates Foundation et le PNUD ont établi un nouveau partenariat public-privé nommé Global Health Innovative Technology Fund. Les membres ont ainsi engagé cent millions de dollars sur cinq ans destinés à financer des partenariats de recherche et développement au Japon et ailleurs afin de travailler sur de nouveaux médicaments et vaccins de dix-sept maladies tropicales négligées en plus du VIH, du paludisme et de la tuberculose[52],[53],[54]. Le faible coût des vaccins et médicaments ainsi développés est un des critères majeurs à l'obtention des financements[52].
WIPO Re:Search est un programme fondé en 2011 par l'Organisation mondiale de la propriété intellectuelle (OMPI) en collaboration avec BIO Ventures for Global Health (BVGH) et la participation de compagnies pharmaceutiques majeures et d'autres organisations de recherche privées ou publiques. Ce programme permet aux organismes de partager leur propriété intellectuelle, leurs composés, leur expertise, leurs infrastructures et leur expérience de manière libre de droit avec des chercheurs qualifiés internationaux dans le domaine des NTDs, du paludisme et de la tuberculose[55],[56].
Notes et références[modifier | modifier le code]
- Hotez PJ, Kamath A, « Neglected tropical diseases in sub-saharan Africa: review of their prevalence, distribution, and disease burden. », PLoS Negl Trop Dis., vol. 3(8), (PMID 19707588, lire en ligne)
- (en) « Making the Case to Fight Schistosomiasis », National Public Radio, (lire en ligne, consulté le )
- Hotez PJ, « A plan to defeat neglected tropical diseases. », Sci Am., vol. 302(1), , p. 90-94, 96 (PMID 20063641, lire en ligne)
- Mike Shanahan, « Beat neglected diseases to fight HIV, TB and malaria », SciDev.Net,
- (en) M. Reddy, S. S. Gill, S. R. Kalkar, W. Wu, P. J. Anderson et P. A. Rochon, « Oral drug therapy for multiple neglected tropical diseases: a systematic review. », JAMA, vol. 298, no 16, , p. 1911-1924 (PMID 17954542, lire en ligne)
- (en) « DNDi / Best science for the most neglected », sur Drugs for Neglected Diseases initiative (DNDi) (consulté le ).
- (en) « Ending the neglect to attain the Sustainable Development Goals: A road map for neglected tropical diseases 2021–2030 », sur www.who.int (consulté le )
- Collaborators GBD 2013 Mortality and Causes of Death, « Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013. », Lancet, vol. 385, no 9963, , p. 117–71 (PMID 25530442, DOI 10.1016/S0140-6736(14)61682-2)
- (en) « World Health Organization », sur World Health Organization, World Health Organization (consulté le ).
- (en) Alice Trotter et Ioana Cismas, « Framing Noma : Human Rights and Neglected Tropical Diseases As Paths for Advocacy », dans Justice in Global Health, Routledge,
- (en) « Trypanosomiasis, human African (sleeping sickness) », sur www.who.int (consulté le )
- Peter G. E. Kennedy et Jean Rodgers, « Clinical and Neuropathogenetic Aspects of Human African Trypanosomiasis », Frontiers in Immunology, vol. 10, (ISSN 1664-3224, DOI 10.3389/fimmu.2019.00039/full, lire en ligne, consulté le )
- « World Health Day 2014: small bite, big threat » (consulté le )
- « Chagas disease (American trypanosomiasis) » (consulté le )
- (en) « Chagas disease », sur www.who.int (consulté le )
- « Burden and Distribution » (consulté le )
- (en) « Leishmaniasis », sur www.who.int (consulté le )
- (en) « Leprosy (Hansen's disease) », sur www.who.int (consulté le )
- Anouk van Hooij, Susan J.F. van den Eeden, Marufa Khatun, Santosh Soren, Kees L.M.C. Franken, Johan Chandra Roy, Khorshed Alam, Abu Sufian Chowdhury, Jan Hendrik Richardus et Annemieke Geluk, « BCG-induced immunity profiles in household contacts of leprosy patients differentiate between protection and disease », Vaccine, vol. 39, no 50, , p. 7230-7237 (lire en ligne
 )
)
- « Buruli Ulcer » (consulté le )
- Feasey N, Wansbrough-Jones M, Mabey DC, Solomon AW, « Neglected tropical diseases. », Br Med Bull, vol. 93, , p. 179-200 (PMID 20007668, lire en ligne)
- (en) « Trachoma », sur www.who.int (consulté le )
- Goldschmidt P, Einterz E, « The limits of medical interventions for the elimination of preventable blindness. », Trop Med Health, vol. 42, no 1, , p. 43-52 (PMID 24808746, lire en ligne)
- (en) « Yaws », sur www.who.int (consulté le )
- « Transmission of taeniasis/cysticercosis » (consulté le )
- (en) « Taeniasis/Cysticercosis », sur www.who.int (consulté le )
- (en) « Cysticercosis — Level 3 cause | Institute for Health Metrics and Evaluation », sur www.healthdata.org (consulté le )
- « Surveillance, prevention and control of echinococcosis » (consulté le )
- « Dracunculiasis » (consulté le )
- (en-US) « Update: 14 Human Cases of Guinea Worm Reported in 2023 », sur The Carter Center (consulté le )
- « Dracunculiasis eradication — global surveillance summary, 2009 », Wkly. Epidemiol. Rec., World Health Organization, vol. 85, no 19, , p. 166–76 (PMID 20449943, lire en ligne [PDF])
- Fenwick A, « The global burden of neglected tropical diseases. », Public Health, vol. 126, no 3, , p. 233-236 (PMID 22325616, lire en ligne)
- « Forms of Lymphatic Filariasis and diagnosis » (consulté le )
- « Lymphatic filariasis » (consulté le )
- Mohammed KA, Hail HJ, Gabrielli AF. et al., « Triple Co-Administration of Ivermectin, Albendazole and Praziquantel in Zanzibar: A Safety Study », PLoS Negl Trop Dis, vol. 2, no 1, , e171 (PMID 18235853, PMCID 2217668, DOI 10.1371/journal.pntd.0000171)

- (en) « Onchocerciasis (river blindness) », sur www.who.int (consulté le )
- (en) « Schistosomiasis », sur www.who.int (consulté le )
- (en) « Rabies », sur www.who.int (consulté le )
- « Chromomycose », sur www.who.int (consulté le )
- Conteh L, Engels T, Molyneux DH, « Socioeconomic aspects of neglected tropical diseases. », Lancet, vol. 375, no 9710, , p. 239-47 (PMID 20109925, lire en ligne)
- Molyneux DH, « "Neglected" diseases but unrecognised successes--challenges and opportunities for infectious disease control. », Lancet, vol. 364, no 9431, , p. 380-3 (PMID 15276399, lire en ligne)
- « Deworm the World: the evidence for school-based deworming »
- Weiss MG, « Stigma and the social burden of neglected tropical diseases », PLoS Negl Trop Dis, vol. 2, no 5, , e237 (PMID 18478049, PMCID 2359851, DOI 10.1371/journal.pntd.0000237, lire en ligne)

- (en) Mathieu Bangert, David H. Molyneux, Steve W. Lindsay, Christopher Fitzpatrick et Dirk Engels, « The cross-cutting contribution of the end of neglected tropical diseases to the sustainable development goals », PubMed, (PMID 28372566, PMCID PMC5379574, DOI 10.1186/s40249-017-0288-0, lire en ligne)
- Hotez PJ, « NTDs V.2.0: "blue marble health"--neglected tropical disease control and elimination in a shifting health policy landscape. », PLoS Neglected Tropical Diseases, vol. 7, no 11, (PMID 24278496, lire en ligne)
- Rilkoff H, Tukahebwa EM, Fleming FM, Leslie J, Cole DC, « Exploring gender dimensions of treatment programmes for neglected tropical diseases in Uganda », PLoS Negl Trop Dis, vol. 7, no 7, , e2312 (PMID 23875047, PMCID 3708858, DOI 10.1371/journal.pntd.0002312, lire en ligne)

- (en) « Subscribe to read - Financial Times », sur Financial Times (consulté le ).
- Frew SE, Liu VY, Singer PA, « A business plan to help the 'global South' in its fight against neglected diseases », Health Aff (Millwood), vol. 28, no 6, , p. 1760–73 (PMID 19887417, DOI 10.1377/hlthaff.28.6.1760, lire en ligne)
- Keenan JD, Hotez PJ, Amza A, et al., « Elimination and eradication of neglected tropical diseases with mass drug administrations: a survey of experts », PLoS Negl Trop Dis, vol. 7, no 12, , e2562 (PMID 24340111, PMCID 3855072, DOI 10.1371/journal.pntd.0002562, lire en ligne)

- « FDA Approves Coartem Tablets to Treat Malaria », USFDA (consulté le )
- « Giving What We Can; recommended interventions »
- "Japan in pioneering partnership to fund global health research", by Andrew Jack, Financial Times, May 30, 2013
- "An Audience with… Tachi Yamada", by Asher Mullard, Nature magazine, September 2013, Volume 12, p. 658
- "Joining the Fight Against Neglected Diseases", Science magazine, June 7, 2013, Volume 340, p. 1148
- Ramamoorthi R, Graef KM, Dent J, « WIPO Re:Search: Accelerating anthelmintic development through cross-sector partnerships. », Int J Parasitol Drugs Drug Resist., vol. 4, no 3, , p. 220-5 (PMID 25516832, lire en ligne)
- « WIPO Re:Search » (consulté le )
